Рис. 1. Молекулы ДНК контрастированы уранилацетатом и адсорбированы на слюду
АСМ-исследование, контактный режим.
Размер кадра 2,3´ 2,3 мкм2
НУКЛЕИНОВЫЕ КИСЛОТЫ
Среди множества биологических объектов, к исследованию которых применялись методы зондовой микроскопии, первой была молекула дезоксирибонуклеиновой кислоты (ДНК). Однако на начальном этапе этих исследований отмечались сложности в интерпретации получаемых изображений. Так, авторы работ [Travaglini et al., 1987; Dunlap, Bustamante, 1989] представили данные сканирующей туннельной микроскопии (СТМ) по изучению молекул ДНК, адсорбированных на подложку из высокоориентированного пиролитического графита (пирографита). Выбор данного материала в качестве подложки был обусловлен его проводящими свойствами, а также простотой приготовления атомарно гладких участков поверхности значительной площади. На СТМ-изображениях наблюдались протяженные цепочки, обладающие продольной периодичностью (период около 2–3 нм), на основании чего авторы делали вывод о визуализации витков двойной спирали.
Однако позднее были опубликованы данные [Clemmer, Beebe, 1991], свидетельствующие о возможности наблюдения сходных “ДНК-подобных” структур при исследовании методом СТМ чистой, свежесколотой поверхности пирографита. Возникновение таких структур объясняется чувствительностью СТМ к электронным свойствам поверхности — происходит визуализация доменных стенок пирографита [Heckl, Binning, 1992]. Эти результаты, а также слабая воспроизводимость и отсутствие безусловно необходимых контрольных экспериментов в первых работах по СТМ-визуализации ДНК вызывали сомнения в применимости методов зондовой микроскопии для исследования макромолекул, адсорбированных на поверхности пирографита.
Существенное изменение ситуации произошло в 1992 г., когда были опубликованы первые надежные, стабильные и воспроизводимые результаты исследования ДНК методом атомно-силовой микроскопии (АСМ) [Bustamante et al., 1992; Vesenka et al., 1992]. Эти публикации убедительно продемонстрировали уникальные возможности применения методов зондовой микроскопии к исследованию биологических объектов при условии использования адекватной методики приготовления образцов для иммобилизации исследуемых структур на подложке.
Методики приготовления образцов для зондовой микроскопии нуклеиновых кислот
Универсальных методик приготовления образцов для решения широкого спектра задач зондовой микроскопии пока не существует, поэтому в каждом конкретном случае специфика задачи требует экспериментального определения адекватной процедуры иммобилизации исследуемых структур на подложке. При этом в большинстве случаев бывает необходимо, чтобы молекулы нуклеиновых кислот адсорбировались на подложку в развернутом состоянии. В настоящее время для анализа свойств данных макромолекул методом зондовой микроскопии апробирован целый ряд различных подходов к приготовлению образцов. Ниже остановимся подробнее на основных из них.
Первые надежные результаты исследования ДНК методом атомно-силовой микроскопии были получены в том случае, когда изучаемые структуры наносили из капли рабочего раствора (раствора буфера, водно-спиртовой среды и т.п.) на поверхность слюды, модифицированной ионами металлов Mg2+, Zn2+, Co2+, La3+, Zr4+ и т.п. [Bustamante et al., 1992; Vesenka et al., 1992]. Эти ионы, по-видимому, служат связующими мостиками между отрицательно заряженной слюдой и отрицательно заряженными фосфатными группами молекулы ДНК (при нейтральном pH рабочих растворов). Модификация слюды может предшествовать процессу адсорбции макромолекул — в этом случае свежесколотую слюду помещают для предварительной обработки на некоторое время (минуты, часы) в раствор, содержащий катионы металлов, затем ее промывают дистиллированной водой и высушивают. После этого на модифицированную поверхность слюды наносят рабочий раствор с исследуемыми структурами. Другой подход — добавление солей металлов непосредственно к рабочему раствору — позволяет исключить этап предварительной обработки слюды (образцы наносят непосредственно на свежесколотую поверхность слюды). В этом случае процессы адсорбции макромолекул и формирования ионных мостиков протекают коррелированно. После высыхания капли рабочего раствора образцы, как правило, подвергают дополнительной промывке (в дистиллированной воде или в водно-спиртовой среде) для уменьшения поверхностной концентрации примесей.
В работе [Thundat et al., 1992] методом АСМ проводили сравнительный анализ процесса адсорбции макромолекул ДНК на слюду, как с использованием стабилизирующих катионов металлов, так и без них. Было показано, что во втором случае адсорбированные молекулы нестабильны в процессе предварительной промывки образцов и при сканировании. Кроме того, макромолекулы характеризуются большим количеством запутанных и перекрученных участков, тогда как при использовании связующих ионов и применении предшествующей сканированию промывки образцов молекулы ДНК адсорбируются на поверхность подложки в расправленном состоянии.
Авторы работы [Thomson et al., 1996] исследовали методом АСМ в жидкостной ячейке обратимое осаждение молекул ДНК при различных параметрах исходного раствора в реальном масштабе времени. Было показано, что адсорбция макромолекул ДНК на поверхность подложки (слюды) и величина силы адгезии существенно зависят от концентрации связующих ионов (оптимальное значение около 2 мМ для Zn2+) и показателя pH среды (оптимальное значение около 7,5).
На сегодняшний день использование катионов металлов для связывания макромолекул с подложкой является, пожалуй, наиболее распространенной методикой приготовления образцов при проведении АСМ-исследований нуклеиновых кислот, что объясняется ее простотой и высокой воспроизводимостью результатов. На рис. 1 представлены АСМ-изображения молекул ДНК, контрастированных уранилацетатом и адсорбированных наповерхность слюды.
|
|
Рис. 1. Молекулы ДНК контрастированы уранилацетатом и адсорбированы на слюду АСМ-исследование, контактный режим. Размер кадра 2,3´ 2,3 мкм2 |
Другая широко используемая методика химической модификации подложки для стабилизации молекул нуклеиновых кислот на поверхности — это силанизация слюды [Hu et al., 1996]. Процесс силанизации не изменяет топографических особенностей поверхности слюды — она остается достаточно гладкой. В то же время улучшается связь макромолекулы с модифицированной подложкой, что повышает стабильность макромолекулы в процессе сканирования и обеспечивает возможность промывки поверхности, подлежащей исследованию. В работе [Lyubchenko, Gall et al., 1992] при проведении АСМ-исследований нуклеиновых кислот (ДНК, двунитевой рибонуклеиновой кислоты (РНК)) в качестве подложки использовали поверхность слюды, химически модифицированную 3-аминопропилтриэтокси силаном (APTES). Модификация включала ковалентную привязку аминогрупп молекул APTES к слюде, степень модификации контролировалась с помощью АСМ и выбиралась таким образом, чтобы шероховатость получаемой поверхности не затрудняла идентификацию исследуемых структур.
Было показано [Lubchenko, Jacobs et al., 1992], что применяемая методика достаточно удобна для проведения исследований распределения молекул нуклеиновых кислот по длинам. Представленные авторами результаты совпадали с данными электронной микроскопии (исследовались молекулы двунитевой РНК реовируса), при этом было показано, что при равенстве разрешающих способностей важным преимуществом АСМ является существенно менее сложная методика приготовления образцов.
Была продемонстрирована возможность использования модифицированной слюды при проведении исследований как на воздухе, так и в водной среде, — в обоих случаях величина адгезии молекул нуклеиновых кислот к подложке позволяла осуществлять сканирование в контактном режиме. Авторы [Lyubchenko et al., 1993] осуществляли сканирование одного и того же участка поверхности с адсорбированными макромолекулами на воздухе и в воде, при этом во втором случае наблюдалось увеличение разрешающей способности (примерно в три раза), что может быть связано с исключением негативного влияния капиллярных сил. Данные силы возникают из-за формирования водяного мениска между зондом и образцом за счет тонкой водной пленки, покрывающей поверхности при проведении исследований на воздухе. Капиллярные силы увеличивают силовое воздействие зонда на образец, что вызывает деформации макромолекулы или ее нестабильность в процессе сканирования и приводит к уменьшению разрешающей способности.
Другие исследователи также сообщают, что если АСМ-исследования проводятся либо в сухой газовой атмосфере (иногда для уменьшения относительной влажности температуру рабочей атмосферы повышают до 60–100° С [Прохоров и др., 1996]), либо в жидкостной ячейке [Hansma H.G. et al., 1992; Yang, Shao, 1993], то влияние капиллярных сил уменьшается, что увеличивает достигаемое пространственное разрешение. Применение режима прерывистого контакта (tapping mode) [Zhong et al., 1993; Hansma P.K. et al., 1994] также позволяет исключить влияние капиллярных сил. Результат подобного АСМ-исследования молекул ДНК приведен на рис. 2.
|
|
Рис.2. Фрагмент молекулы ДНК, адсорбированной на слюду. АСМ-исследование, режим прерывистого контакта Размер основного кадра 0,2´ 0,2 мкм2 |
На пути подбора адекватного подхода к приготовлению образцов может оказаться полезным накопленный за десятилетия исследований багаж соответствующих методик электронной микроскопии. В упрощенном варианте многие из этих методик могут применяться и для решения задач зондовой микроскопии. Так, модифицированный метод Кляйншмидта (метод белковой пленки) дает хорошие результаты при использовании гидрофобных подложек [Yang et al., 1992].
Для разворачивания молекул ДНК на поверхности подложки применяют также хлорид бензилдиметилалкиламмония (BAC) [Schaper et al., 1993; Jelen et al., 1994] — широко используемый в электронной микроскопии реагент, представляющий собой катионное поверхностно-активное вещество (ПАВ). BAC в малых концентрациях (около 5× 10-5%) добавляют непосредственно в раствор, содержащий макромолекулы перед нанесением их на поверхность слюды. Вследствие свойств ПАВ, на поверхности капельки, наносимой на подложку, формируется стабильная пленка молекул BAC (со связанными с ней молекулами ДНК), которая потом распределяется по поверхности слюды и стабилизируется за счет сил электростатического взаимодействия. Добавление к рабочему раствору других ПАВ (в малых концентрациях) также способствует стабилизации молекул нуклеиновых кислот на поверхности слюды. Так, в работе [Schaper et al., 1994] для разворачивания ДНК на поверхности успешно применили 2,4,6-трис(диметиламинометил)фенол (DMP-30) и хлорид цетилпиридиния (CP), представляющие собой, соответственно, неионное и катионное ПАВ. На рис. 3 приведен результат АСМ-исследования [Sergeyev et al., 1998] ДНК бактериофага Т4, адсорбированной на поверхность слюды из раствора, содержащего малые концентрации бромида цетилтриметиламмония (ЦТАБ).
|
|
Рис.3. Молекулы ДНК бактериофага Т4
адсорбированы из буфера в присутствии бромида цетилтриметиламмония на
слюду АСМ-исследование, контактный режим.
Размер кадра 8´ 8 мкм2 |
Успехи применения атомно-силовой микроскопии к исследованию молекул нуклеиновых кислот позволили достичь прогресса и при проведении подобных экспериментов методами сканирующей туннельной микроскопии. Хорошие результаты были получены при СТМ-исследовании молекул ДНК, адсорбированных на химически модифицированных поверхностях металлов [Bottomley et al., 1992]. Химическая модификация включала ковалентную связь химически поляризуемых групп тиолов с чистой поверхностью металла. Адсорбция ДНК осуществлялась за счет кулоновского взаимодействия молекулы с плотно упакованной мономолекулярной пленкой тиолов, ориентированных положительными функциональными группами в направлении к поверхности молекулы ДНК. Характерной особенностью представленных в работе [Allison et al., 1993] изображений молекул ДНК является отрицательный контраст (при движении над молекулой туннельная игла опускается ниже, чем при движении над поверхностью подложки), связанный, по-видимому, со слабой проводимость макромолекулы.
Другой перспективный подход к исследованию макромолекул методами СТМ — применение низкотоковой туннельной микроскопии [Dunlap, 1996] с рабочим диапазоном туннельного тока менее 1 пА. В этом случае экспериментальные результаты [Guckenberger et al., 1994] свидетельствуют о возможности визуализации молекул ДНК, адсорбированных на поверхности диэлектрической подложки (слюды). Транспорт заряда в системе зонд-образец-подложка осуществляется за счет проводимости ультратонкой пленки воды, покрывающей поверхности образца и подложки при проведении исследований в условиях контролируемой относительной влажности. Согласно экспериментальным результатам оптимальное значение последней составляет 60–65%.
При использовании адекватной методики приготовления образцов сканирующий зондовый микроскоп представляет собой удобный и надежный прибор для исследования свойств биологических структур на молекулярном уровне. Убедительным доказательством этого утверждения могут служить результаты работ, посвященных исследованию конформационных свойств молекул нуклеиновых кислот и их комплексов с белками, поверхностно активными веществами и т.п.
Авторы работы [Hansma H.G. et al., 1994] исследовали влияние определенных лигандов (дистамицина и микрогонотропена-6b) на конформационные свойства нескольких типов молекул ДНК с помощью АСМ в режиме прерывистого контакта. Результаты исследований не только обеспечили визуальное доказательство влияния данных лигандов на конформацию ДНК, но и позволили сделать определенные количественные оценки, основанные на анализе представленных авторами гистограмм распределения расстояния между концами ДНК. Возможность набора статистики, основанной на анализе большого количества изображений отдельных молекул ДНК (100–200 и более), повышает достоверность интерпретации полученных результатов и свидетельствует о высокой надежности метода зондовой микроскопии.
В работе [Rees et al., 1993] исследовали комплексы РНК-полимеразы из Escherihia coli с ДНК, содержащей l PL промотор. Образованные комплексы были визуализированы методом АСМ, на полученных изображениях наблюдались молекулы ДНК с РНК-полимеразой, локализованной на расстоянии 4¤ 9 от одного из концов. Проводился анализ структуры комплекса РНК-полимеразы и ДНК как в открытых комплексах, связанных с промотором (OPCs), так и в стабильных элонгационных комплексах (С15) с образованным 15-нуклеотидным транскриптом. Было показано, что в области прикрепления РНК-полимеразы происходит изгиб молекулы ДНК, причем средний угол изгиба для OPCs и С15 составлял 54 ± 31° и 92 ± 37° , соответственно (распределение угла изгиба для того же участка шаблона в отсутствии РНК-полимеразы является гауссовым с центром в 0° ). На основании обнаруженного различия в значениях средних углов изгиба для OPCs и C15 авторы делают вывод, что процесс транскрипции сопровождается изменением структуры комплекса РНК-полимеразы с ДНК, обусловленной конформационными изменениями полимеразы.
Авторы работы [Sergeyev et al., 1997] применили ряд методик (в том числе зондовую микроскопию) для исследования конформационных свойств комплексов ДНК-ПАВ. Было показано, что при взаимодействии ДНК с ПАВ происходит сворачивание макромолекулы в компактный тороидальный комплекс. Вывод о тороидальной структуре данных компактизованных комплексов сделан именно на основании результатов исследования зондовой микроскопии. Наряду с этим было обнаружено, что тороподобные комплексы ДНК-ПАВ, образованные в водной фазе, растворимы в хлороформе, в то время как ДНК в отсутствие поверхностно-активных веществ в хлороформе не растворяется [Пышкина и др., 1996]. В случае образования этих комплексов в двухфазной системе вода/хлороформ гидрофобные частицы комплекса ДНК-ПАВ оказываются нерастворимыми в водной среде и переходят в малополярный органический растворитель — хлороформ, пересекая границу раздела фаз. Методы АСМ позволили визуализировать тороподобные комплексы ДНК-ПАВ, перешедшие через границу раздела фаз в хлороформ [Андреева и др., 1997]; результаты представлены на рис. 4.
Подобные исследования с применением зондовой микроскопии для изучения конформационных превращений молекул ДНК в различных средах, моделирующих внутреннюю часть липидного бислоя биологических мембран, открывает уникальную возможность для понимания механизмов трансмембранного переноса [Пышкина, 1997].
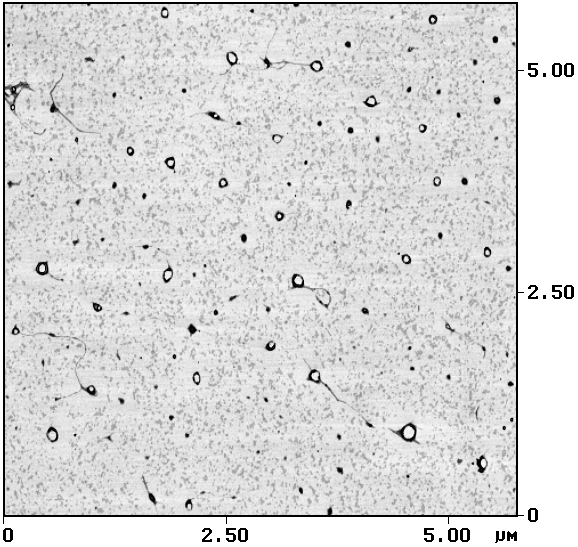 |
Рис. 4. Изображение тороподобных комплексов
ДНК-ПАВ В качестве ПАВ использовали хлорид
дистеарилдиметиламмония; макромолекулы ДНК состояли из 300–500 пар оснований.
Комплексы образованы в водной фазе, переведены через границу раздела фаз
в хлороформ и из хлороформа адсорбированы на поверхность слюды. АСМ-исследование,
контактный режим. Размер кадра 6´ 6 мкм2 |
Ту же природу имеет компактная тороидальная морфология макромолекулы ДНК в водно-спиртовых средах. Известно, что в водно-спиртовых средах различные мультивалентные катионы, в том числе двухвалентные катионы металлов, вызывают конденсацию ДНК [Bloomfield, 1991]. Но и в отсутствии конденсирующих агентов методами АСМ были визуализированы компактные тороидальные структуры, образованные молекулами ДНК в 50%-ной смеси изопропанола и 0,05 М ТВЕ буфера [Галлямов и др., 1998] — рис. 5.
Возможный механизм образования данных структур состоит в том, что в присутствии спирта противоионы натрия сближаются с отрицательно заряженными фосфатными группами молекулы ДНК, экранируя тем самым электростатическое отталкивание витков двойной спирали и переводя макромолекулу в компактное тороидальное состояние.
Возможность АСМ-визуализации молекулярных процессов продемонстрирована в работе [Guthold et al., 1994] на основе последовательного анализа процесса образования неспецифичных комплексов молекулы ДНК и РНК-полимеразы в реальном масштабе времени. Схема эксперимента включала в себя адсорбцию макромолекул ДНК на слюду из 10 мM HEPES буфера в присутствии ионов магния (1–10 мM MgCl2), затем следовали промывка и высушивание образцов в эксикаторе. После этого образцы помещали в жидкостную ячейку микроскопа, начинали процесс сканирования, а затем в раствор вводили РНК-полимеразу. Было показано, что образование комплексов белок-ДНК наблюдается уже через несколько секунд после добавления полимеразы, что свидетельствует о сохранении нативной конфигурации РНК-полимеразы и ДНК в процессе приготовления образцов и
 |
Рис. 5. Тороидальные структуры, образованные
молекулами ДНК в 50%-ной смеси изопропанола и буфера, нанесены на поверхность
слюды АСМ-исследование, контактный режим. Размер кадра 2,5´ 2,5 мкм2 |
проведения исследований. На основе анализа распределения участков связывания белка относительно концов ДНК делался вывод о преобладании неспецифичного взаимодействия, однако диффузия РНК-полимеразы вдоль молекулы ДНК не наблюдалась, что, возможно, объясняется влиянием подложки. Данные результаты демонстрируют возможность использования зондовой микроскопии для исследования процессов, ответственных за распознавание и сборку макромолекулярных комплексов в физиологических условиях.
Большое прикладное значение имеет возможность решения методом АСМ задачи картирования ДНК. Специфические участки макромолекулы помечаются определенными маркерами, анализ местоположения этих маркеров на получаемых АСМ-изображениях позволяет составлять карты относительного расположения определенных участков последовательности нуклеотидов. Так, в работе [Murray et al., 1993] продемонстрирована возможность визуализации местоположения биотина, ковалентно привязанного к первому нуклеотиду праймера. Биотин помечался белковым комплексом стрептавидин-стафиллококковый белок А (стрептавидин имеет высокую способность связывания с биотином, а белок А увеличивает размеры маркера для однозначной его идентификации на АСМ-изображениях).
В работе [Клинов, 1997] был предложен метод картирования клонированных в плазмидный вектор последовательностей LRT (длинные концевые повторы) с помощью R-петель, наблюдаемых в АСМ. R-петли формировались последовательностями РНК из 345 и 380 нуклеотидных оснований, комплементарными к U3 и U5 областям LTR человеческого эндогенного ретровируса K-10 (HERV-K10). Различная длина зондов позволяла уже из одной гистограммы определить как положение, так и ориентацию LTR. Полученные результаты позволяют предположить, что в будущем разрешение приборов СЗМ может быть достаточным для определения последовательности нуклеотидов ДНК.
Взаимодействие РНК вируса табачной мозаики и вирусного белка играет важную роль в процессах размножения вирусов. Важный вклад в понимание механизма данных процессов может дать исследование последовательного освобождения РНК от белковой оболочки под действием соответствующих реагентов. Подобное исследование было проведено методом АСМ [Drygin et al., 1997]. В данной работе представлены результаты исследования разрушения вирусных частиц под действием диметилсульфоксида (ДМСО), мочевины и в водных растворах с щелочным значением pH. АСМ-исследование промежуточных стадий разрушения вирусных частиц показало, что процесс высвобождения молекулы РНК протекает одинаково во всех трех случаях. На рис. 6 представлены АСМ-изображения цельных вирусных частиц до начала процесса обработки. Высота вирусных частиц составляет 20 нм над поверхностью подложки. Неравномерное распределение длин вирусных частиц объясняется, по-видимому, межвирусной агрегацией “торец в торец” двух, трех и более вирусов (в предположении монодисперсности препарата вируса).
 |
Рис. 6. Отдельные частицы вируса табачной мозаики адсорбированы на поверхность пирографита АСМ-исследование, режим прерывистого контакта. Размер кадра 2,5´ 2,5 мкм2 |
 |
Рис. 7. Промежуточная стадия обработки вирусных частиц диметилсульфоксидом (ДМСО) Наблюдаются частично разрушенные вирусы и выходящие из белковой оболочки молекулы РНК. Структуры адсорбированы на подложку из слюды. АСМ-исследование, контактный режим. Размер кадра 7,5´ 7,5 мкм2 |
На рис. 7 изображены частично разрушенные вирусные частицы: наблюдаются отдельные молекулы РНК, выходящие из вирусных остатков. Набранная статистика свидетельствует о том, что в большинстве случаев РНК выходит из торца одиночной вирусной частицы. Наблюдаемые исключения из данного правила являются следствием той же агрегации “торец в торец” частично разрушенных вирусных структур. В случае, когда несколько вирусных остатков образуют агрегат, нити РНК, выходящие из агрегатной структуры, могут служить маркерами для концов вирусных частиц. На рис. 8 приведены результаты исследования заключительной стадии процесса обработки — визуализированы полностью освобожденные от белковой оболочки молекулы РНК. Результатом работы является демонстрация применимости АСМ для исследования взаимодействия РНК с белками — в частности, возможности решения задачи картирования данного взаимодействия.
Еще одно важное преимущество прибора зондового микроскопа как средства, позволяющего проводить прецизионные исследования локальных свойств поверхности, продемонстрировали авторы работы [Lee et al., 1994]. Они проводили прямые исследования силового взаимодействия, ответственного за формирование витков молекулы ДНК, по следующей схеме.
На поверхностях подложки и кремниевого микрозонда создавались два типа покрытия, представляющего собой слой ковалентно привязанных за один из концов определенных комплементарных олигомеров — в одном случае (АЦТГ)5, в другом (ЦАГТ)5. В процессе взаимодействия пары данных нуклеотидов (длиной в 20 оснований) возможно образование комплексов с 20, 16, 12, 8 и 4 парами взаимодействующих оснований.
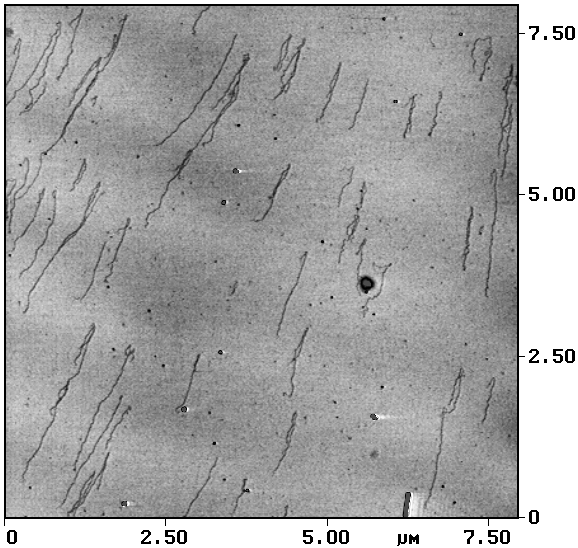 |
Рис. 8. Макромолекулы РНК полностью
освобождены от белковой оболочки в результате обработки вирусных частиц
70%-ным раствором ДМСО Структуры стабилизированы на поверхности
слюды. АСМ-исследование, контактный режим. Размер кадра 7,5´ 7,5 мкм2 |
В ходе эксперимента многократно измерялась кривая силового взаимодействия F(z) между зондом и подложкой. На основании этих результатов определяли силу адгезии и строили гистограммы ее распределения. В случае отсутствия специфического взаимодействия между комплементарными участками наблюдалось бы однородное гауссово распределение для силы адгезии. Однако на полученных гистограммах четко прослеживались отдельные пики (1,52 ± 0,19; 1,1 ± 0,13; 0,83 ± 0,11 нН), ответственные за специфическое взаимодействие между 12, 16 и 20 образованными парами оснований для единичной пары комплементарных нуклеотидов (авторы указывают, что комплексы с 8 и 4 взаимодействующими парами оснований термодинамически нестабильны при 27° С — температуре проведения исследований).
Сходная экспериментальная схема — с образованием между взаимодействующими поверхностями “мостиков” в виде отдельных нитей молекулы ДНК длиной в 160 оснований — использовалась для анализа внутримолекулярных упругих свойств. Таким образом, авторам удалось продемонстрировать возможность применения АСМ для прямого количественного анализа межмолекулярного и внутримолекулярного взаимодействия в комплексах биологических и синтетических макромолекул, что открывает новые перспективы для обнаружения и локализации специфических последовательностей нуклеотидов с ангстремным разрешением.
ЛИТЕРАТУРА
Андреева А.С., Галлямов М.О., Зезин А.Б., Пышкина О.А., Сергеев В.Г., Яминский И.В. (1997) Изучение конформационного перехода ДНК методом атомно-силовой микроскопии // Сборник кратких сообщений второго Белорусского семинара по сканирующей зондовой микроскопии (Минск, Беларусь, 23–24 мая 1997г.). Минск: ЗАО “Деловая инициатива” 15–17.
Галлямов М.О., Пышкина О.А., Сергеев В.Г., Яминский И.В. (1998) Применение методов сканирующей зондовой микроскопии к исследованию конформационных свойств ДНК // Поверхность. № 2 (в печати).
Клинов Д.В. (1997) Исследование биополимеров методами сканирующей зондовой микроскопии: Автореф. дис. ¼ канд. физ.-мат. наук. М.: МФТИ. 20 с.
Прохоров В.В., Клинов Д.В., Юркова Е.В., Демин В.В. (1996) Исследования возможностей атомно-силовой микроскопии при картировании ДНК // Материалы 16-ой Российcкой конференции по электронной микроскопии. Черноголовка. 227.
Пышкина О.А. (1997) Комплексы ДНК-ПАВ в малополярных органических растворителях: Автореф. дис. ¼ канд. хим. наук. М.: МГУ. 22 с.
Пышкина О.А., Сергеев В.Г., Зезин А.Б., Кабанов В.А. (1996) Высокомолекулярную ДНК можно растворить в малополярных органических растворителях путем комплексования с катионными поверхностно-активными веществами // ДАН. 348(4) 496–498.
Allison D.P., Thundat T., Jacobson K.B., Bottomley L.A., Warmack R.J. (1993) Imging entire genetically functional DNA molecules with the scanning tunneling microscope // J.Vac.Sci.Technol A. 11(4) 816–819.
Bloomfield V.A. (1991) Condensation of DNA by multivalent cations: consideration on mechanism // Biopolymers. 31 1471–1481.
Bottomley L.A., Haseltine J.N., Allison D.P., Warmack R.J., Thundat T., Sachlebe R.A., Brown G.M., Woychik R.P., Jacobson K.B., Ferrell T.L. (1992) Scanning tunneling microscopy of DNA: The chemical modification of gold surfaces for immobilization of DNA // J.Vac.Sci.Technol. A. 10(4) 591–595.
Bustamante C., Vesenka J., Tang C.L., Rees W., Guthod M., Keller R. (1992) Circular DNA molecules imaged in air by scanning force microscopy // Biochemistry. 31 22–26.
Butt H.-J., Muller T., Gross H. (1993) Immobilizing biomolecules for scanning force microscopy by embedding in carbon // J.Struct.Biol. 110 127–132.
Clemmer C.R., Beebe T.P. (1991) Graphite: A mimic for DNA and other biomolecules in scanning tunneling microscopes studies // Science. 251 640–642.
Drygin Yu.F., Gallyamov M.O., Yaminsky I.V. (1997) AFM investigation of tobacco mosaic virus RNA // Presentation Abstracts of 1997 International NanoScopeÒ Users Conference, (Santa Barbara, California, USA, August 24–27, 1997). Santa Barbara: Digital Instruments 39.
Dunlap D. (1996) Scanning tunneling microscopy of DNA // IEEE engineering in medicine and biology. 46–50.
Dunlap D.D., Bustamante C. (1989) Images of single-stranded nucleic acids by scanning tunneling microscopy // Nature. 342 204–206.
Guckenberger R., Heim M., Cevc G., Knapp H.F., Wiegrabe W., Hillebrand A. (1994) Scanning tunneling microscopy of insulators and biological specimens based on lateral conductivity of ultrathin water films // Science. 266 1538–1540.
Guthold M., Bezanilla M., Erie D.A., Jenkins B., Hansma H.G., Bustamante C. (1994) Following the assembly of RNA polymerase — DNA complexes in aqueous solutions with the scanning force microscope. // Proc.Natl.Acad.Sci. USA. 91 12927–12931.
Hansma H.G., Browne K.A., Bezanilla M., Bruice T.C. (1994) Bending and straightening of DNA induced by the same ligand: Characterization with the atomic force microscope // Biochemistry. 33 8436–8441.
Hansma H.G., Laney D.E., Bezanilla M., Sinsheimer R.L., Hansma P.K. (1995) Application for Atomic Force Microscope of DNA // Biophys. J. 68 1672–1677.
Hansma H.G., Vesenka J., Siegerist C., Kelderman G., Morrett H., Sinsheimer P.L., Elings V., Bustamante C., Hansma P.K. (1992) Reproducible imaging and dissection of plasmid DNA under liquid with atomic force microscopy // Science. 256 1180–1184.
Hansma P.K., Cleveland J.P., Radmacher M., Walters D.A., Hillner P.E., Bezanilla M., Fritz M., Vie D., Hansma H.G., Prater C.B., Massie J., Fukunaga L., Gurley J, Elings V. (1994) Tapping mode atomic force microscopy in liquids // Appl.Phys.Lett. 64(13) 1738–1740.
Heckl W.M., Binning G. (1992) Domain walls on graphite mimic DNA // Ultramicroscopy. 42–44 1073–1078.
Hu J., Wang M., Weier H.-U.G., Frantz P., Kolbe W., Ogletree D.F. (1996) Imaging of single extended DNA molecules on flat (aminopropyl)triethoxysilane-mica by atomic force microscopy // Langmuir. 12(7) 1697–1700.
Jelen F., Vetterl V., Schaper A., Jovin T., Palacek E. (1994) Two-dimensional condensation of benzalkonium chloride at the mercury electrode and its relation to DNA imaging using scanning force microscopy // J.Electroanal.Chem. 377 197–203.
Lee G.U., Chrisey L.A., Colton R.J. (1994) Direct measurements of the forces between complementary strands of DNA // Science. 266 771–773.
Lyubchenko Y.L., Gall A.A., Shlyakhtenko L.S., Harrington R.E., Jacobs B.L., Oden P.I., Lindsay S.M. (1992) Atomic force microscopy imaging of double stranded DNA and RNA // J.Biomol.Struct.Dynam. 10(3) 589–606.
Lubchenko Y.L., Jacobs B.L., Lindsay S.M. (1992) Atomic force microscopy of reovirus dsRNA: a routine technique for length measurements // Nucleic Acids Res. 20(15) 3983–3986.
Lubchenko Y., Shlyakhtenko L., Harrington R., Oden P., Lindsay S. (1993) Atomic force microscopy of long DNA: Imaging in air and under water // Proc.Natl.Acad.Sci. USA. 90 2137–2140.
Murray M.N., Hansma H.G., Bezanilla M., Sano T., Ogletree D.F., Kolbe W., Smith C.L., Cantor C.R., Spengler S., Hansma P.K., Salmeron M. (1993) Atomic force microscopy of biochemically tagged DNA // Proc.Natl.Acad.Sci. USA. 90 3811–3814.
Rees W.A., Keller R.W., Vesenka J.P., Yang G., Bustamante C. (1993) Evidence of DNA bending in transcription complexes imaged by scanning force microscopy // Science. 260 1646–1649.
Schaper A., Pietrasanta L.I., Jovin T.M. (1993) Scanning force microscopy of circular and linear plasmid DNA spread on mica with a quaternary ammonium salt // Nucleic Acids Res. 21(25) 6004–6009.
Schaper A., Starink J.P.P., Jovin T.M. (1994) The scanning force microscopy of DNA in air and in n-propanol using new spreading agents // FEBS Lett. 355 91–95.
Sergeyev V.G., Pyshkina O.A., Gallyamov M.O., Yaminsky I.V., Zezin A.B., Kabanov V.A. (1997) DNA-surfactant complexes in organic media // Progr.Colloid.Polym.Sci. 106 (in press.).
Sergeyev V.G., Pyshkina O.A., Gallyamov M.O., Yaminsky I.V. (1998) To be published.
Thomson N.H., Kasas S., Smith B., Hansma H.G., Hansma P.K. (1996) Reversible binding of DNA to mica for AFM imaging // Langmuir. 12 5905–5908.
Thundat T., Allison D.P., Warmack R.J., Brown G.M., Jacobson K.B., Schrick J.J., Ferrell T.L. (1992) Atomic force microscopy of DNA on mica and chemically modified mica // Scanning Microsc. 6(4) 911–918.
Travaglini G., Rohrer H., Amrein M., Gross H. (1987) Scanning tunneling microscopy on biological matter // Surf.Sci. 181 380–390.
Vesenka J., Guthod M., Tang C.L., Keller R., Delaine E., Bustamante C. (1992) Substrate preparation for reliable imaging of DNA molecules with the scanning force microscope // Ultramicroscopy. 42–44 1243–1249.
Yang J., Shao Z. (1993) The effect of probe force on the resolution of atomic force microscopy of DNA // Ultramicroscopy. 50 157–170.
Yang J., Takeyasu K., Shao Z. (1992) Atomic force microscopy of DNA molecules // FEBS Lett. 301 173–176.
Zhong Q., Inniss D., Kjoller K., Elings V.B. (1993) Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy // Surf.Sci.Lett. 290 L688–L692.