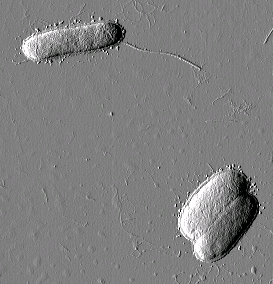
Размер кадра 7,8´ 8,2 мкм2
ЛИПОПОЛИСАХАРИДЫ, КЛЕТОЧНЫЕ СТЕНКИ, ЖИВЫЕ БАКТЕРИАЛЬНЫЕ КЛЕТКИ
Атомно-силовая микроскопия является перспективным методом, позволяющим исследовать особенности структуры поверхности бактерий различных таксономических групп при решении фундаментальных и практических задач биологии и медицины. Авторы осуществили визуализацию бактериальных клеток: Escherichia coli, Klebsiella pneumoniae, Helicobacter pylori, Lactobacillus fermentum и Bifidobacterium longum.
Основными преимуществами метода атомно-силовой микроскопии, используемого для изучения тонких структур бактериальных клеток, по сравнению с традиционными способами — растровой и просвечивающей электронной микроскопии — являются:
1) возможность изучения реальной поверхности клетки без приме–нения специальных методов подготовки образцов (напыления металлами, приготовления реплик и пр.);
2) возможность проведения исследований живых бактерий на воздухе или в различных жидких средах;
3) высокое пространственное разрешение (доли нанометра в плос–кости образца и сотые доли нанометра по нормали к образцу);
4) одновременное исследование с субнанометровым пространствен–ным разрешением локальных свойств клеточной стенки, в том числе, жесткости, пластичности и адгезивности.
При измерении упругих свойств бактериальной стенки можно получать информацию о внутреннем строении клетки. Недавно с помощью атомно-силовой микроскопии зарегистрировано изменение структуры липополисахаридов клеточной стенки бактерий Escherichia coli, наследующих генетическую детерминанту, которая контролирует синтез первичных боковых цепей дизентерийных бактерий [Яминский, Демин, Бондаренко, 1997]. Такие бактерии могут быть использованы в качестве штаммов-носителей при изготовлении живых векторных вакцин.
Атомно-силовая микроскопия продемонстрировала возможность наблюдения динамических изменений в структуре бактерий. В работе Г. Оберлейтнера и др. [Oberleithner et al., 1993] приведены результаты прямых наблюдений образования микропор в бактериальной стенке при воздействии ионов кальция. Размер наблюдаемых пор составлял 30 нм.
В науке о клетках — цитологии — ключевую роль играет прокарио-тическая микробная клетка — кишечная палочка, или эшерихия (Escherichia coli). Благодаря экспериментам с E. coli были изучены основные процессы, происходящие с клетками: рост, деление, деградация, бактериолиз и др.
 |
Рис. 1. Escherichia coli K12 J62 Размер кадра 7,8´ 8,2 мкм2 |
Эшерихия (Escherichia coli), или кишечная палочка, — грамотрицательная микробная клетка семейства кишечных. Имеет слегка вытянутую форму палочки с закругленными концами (0,4–0,8 х 1–3 мкм). В естественных условиях подвижна, факультативный анаэроб, сбраживает глюкозу, лактозу и другие углеводы. Эшерихии — одни из наиболее типичных представителей нормальной микрофлоры кишечника млекопитающих. Является классическим объектом микробиологических и молекулярно-генетических исследований. Изучение разнообразных мутантов штамма Е. coli K12 позволило составить наиболее полную генетическую карту бакте-риальной хромосомы. Культуры E. coli K12 используются в генной инжене-рии в качестве штаммов-носителей при передаче клонированных генов, контролирующих синтез интерферона, инсулина и ряда важных ферментов.
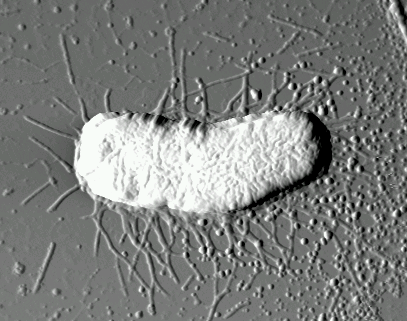 |
Рис. 2. Изображение одиночной
бактерии E. coli JM109, осажденной на поверхность слюды |
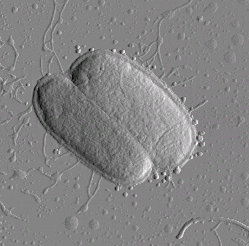
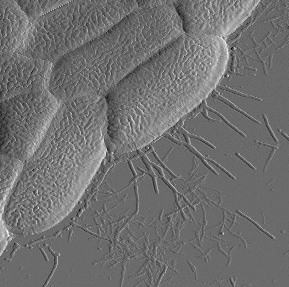
Для штамма E. coli K12 J62 (рис. 1) характерно наличие на поверхности бактериальной стенки длинных отростков — жгутиков. Жгутик представляет собой относительно жесткую спираль, состоящую только из белка — флагеллина. Кишечная палочка — подвижная бактерия, перемещение которой осуществляется с помощью жгутиков. Отростки другого вида (фимбрии, реснички или пили) наблюдаются на поверхности бактерий E. coli JM 109 (рис. 2). Такие ворсинки построены также только из одного вида белка, в данном случае — пилина. Они представляют собой прямолинейные белковые отростки круглого поперечного сечения.
Размеры бактерий E.coli JM109, по данным наблюдений, составляют: длина 1–4 мкм, высота 0,6–1,5 мкм. При высыхании бактерий на твердой подложке заметно их некоторое уплощение. Возвышение бактерий над плоской поверхностью подложки составляет 0,2–0,4 мкм. Результаты атомно-силовой микроскопии указывают на однотипную морфологию поверхности бактериальных клеток. Поверхность клеток имеет структурированную поверхность с характерным периодом 50 нм. На изображении одиночной бактерии (рис. 2) хорошо различимы характерные отростки (пили) длиной в 1–2 мкм.
Для штамма бактерий E. coli HB101 характерно полное отсутствие ресничек (пилей), что хорошо видно на рис. 3.
 |
Рис. 3. Изображение
одиночной бактерии E.coli штамма HB101 Изображение получено в режиме постоянной высоты. Размер кадра 2,8´ 2,5 мкм2. Для оттенения мелких деталей применена боковая подсветка. Воспроизводится из работы [ Яминский, Пышкина и др., 1997 ] |
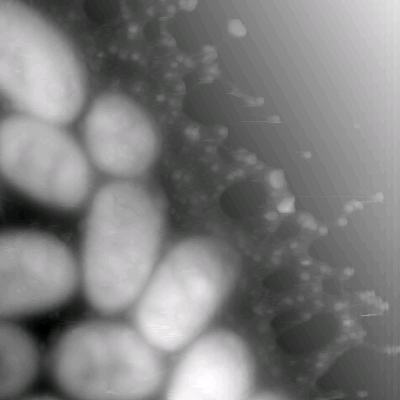 |
Рис. 4. Изображения бактерий Klebsiella
pneumoniae K1 5054 Размер кадра 5,3´ 5,3 мкм2 |
Клебсиелла (Klebsiella) — грамотрицательная, неподвижная, неспорообразующая энтеробактерия, факультативный анаэроб. Klebsiella pneumoniae — наиболее изученная бактерия рода Klebsiella. Обитает на слизистой оболочке носа, рта и кишечника здоровых людей. Условно патогенна: может вызывать воспаление легких и гнойно-воспалительные процессы другой локализации. Сбраживает сахара с образованием 2,3-бутандиола, этанола и органических кислот. На изображениях, полученных с помощью атомно-силового микроскопа, видно, что клебсиеллы не имеют боковых отростков (рис.4). Снаружи клеточная стенка окружена слизистым веществом, плотно обволакивающим клетку. Слизистое образование — капсула – сохраняет механическую связь с клеточной стенкой и имеет аморфное строение. Наблюдаемая в атомно-силовой микроскоп толщина капсулы составляет 0,1 мкм. Капсула является результатом биосинтеза прокариотами органических полимеров и отложения их вокруг клеток.
Геликобактер пилори (Helicobacter pylori) — энтеробактерия, открытая австралийскими учеными в 1983 г. В настоящее время общепризнанно, что H. pylori является возбудителем язвенной болезни двенадцатиперстной кишки (100% случаев заболеваний) и желудка (70% заболеваний). Отдельные бактерии имеют продолговатую форму со средней длиной в 1,5 мкм (рис. 5.).
Методами атомно-силовой микроскопии изучены также другие энтеробактерии [Яминский, Бондаренко, 1998].
 |
Рис. 5. Изображения бактерий Helicobacter
pylori Бактерии нанесены на поверхность слюды. Размер кадра 3,8´ 3,8 мкм2 |
Лактобациллы (Lactobacillus) — обычно неподвижные и бесспоровые молочнокислые бактерии, которые могут осуществлять ферментативное молочнокислое брожение. Являются представителями нормальной микрофлоры кишечника и репродуктивного тракта женщин. Встречаются в молочных, мясных и растительных продуктах, колонизируют эпителий ротовой полости, кишечного и мочеполового трактов теплокровных животных.
Бифидобактерии (Bifidobacterium) — грамположительные, бесспоровые, неподвижные бактерии. Составляют 80–90% нормальной кишечной микрофлоры детей и молодняка сельскохозяйственных животных в период молочного вскармливания.
Приготовление образцов
Для визуализации поверхности микробных клеток методами атомно–силовой микроскопии не требуются специальные подготовительные операции, обязательные для различных видов электронной микроскопии.
Процедура подготовки образцов для атомно-силовой микроскопии заключается в их иммобилизации на ровной подложке. Материал подложки можно варьировать в широких пределах в зависимости от поставленных задач. Традиционно в качестве субстрата используются атомно-гладкие подложки из слюды, графита и других слоистых материалов, а также различные стекла, полимерные материалы и металлические поверхности. Варьируя подложки, можно изучать адгезивные свойства бактерий на поверхности различных материалов.
Хорошо зарекомендовавшая методика нанесения бактерий на поверхность подложки (субстрата) состоит в следующем. Бактерии переносятся в дистиллированную воду и капля воды (~ 4 мкл) с концентрацией около 109 бактерий в 1 мл помещается на поверхность подложки.
В работе И.В. Яминского с соавторами [Яминский, Пышкина и др., 1997] приведено описание методики приготовления микробных клеток E. coli JM 109 и HB 101 и их нанесения на поверхность подложки. Культура клеток была выращена в жидкой среде LB (на 150 мл.: 1,5 г Bacto-trypton, 0,75 г Bacto-yeast extract, 1,5 г NaCl, раствор NaOH до pH 7,5) путем заражения среды соответствующим штаммом в соотношении 1:100 до средней логарифмической фазы (D=0,5 при l =600 нм) при 37oC. Полученные колонии клеток высевались на чашки Петри со средой LB, содержащей агар до 2,25 % и выдерживались при температуре 37oС в течение 8–12 ч. С полученных отдельных колоний скалывали определенное количество клеток для нанесения на соответствующий субстрат.
Свежесколотые бактерии с помощью петли перемещали в дистиллированную воду. Контроль требуемой концентрации бактерий проводили визуально по мутности раствора. Концентрация бактерий перед нанесением составляла 109 в 1 мл. Каплю приготовленного раствора помещали на подложку из свежесколотой слюды размером 6 х 6 мм2. Осаждение бактерий осуществляли также на плоские подложки из других материалов (стекло, полированный титан, пленка из сплава золото-палладий). Первоначальные наблюдения на микроскопе проводили непосредственно через 10–15 мин после нанесения образцов. Последующие измерения осуществляли через более продолжительные интервалы времени (сутки–месяцы). В зависимости от времени наблюдения деградации поверхности бактерий обнаружено не было.
Следует заметить, что кратковременное помещение микробных клеток в дистиллированную воду в процессе приготовления образцов, по наблюдениям зондовой микроскопии, не приводит к лизису (разрушению) клеток. При длительном нахождении клеток в дистиллированной воде (30–60 мин) происходит лизис некоторого количества клеток.
Визуализацию поверхности бактериальных клеток можно осуществлять в различных режимах атомно-силовой микроскопии. В связи с высокой жесткостью клеточной стенки бактерий наблюдения можно проводить в контактном режиме, не предпринимая специальные меры для минимизации силы воздействия острия на поверхность клетки. Режим прерывистого контакта особых преимуществ, как правило, не дает.
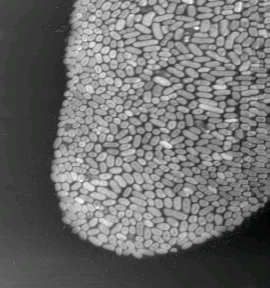
Весьма примечательно, что достаточно простой способ фиксации энтеробактерий приводит к тому, что образуемые островковые структуры являются монослойными. Характерной особенностью наблюдаемой картины является практически полное отсутствие многослойных образований бактерий. Формирование монослойных покрытий, по всей видимости, связано с адгезивными свойствами, присущими энтеробактериям. Можно предположить, что в естественных условиях бактерии также образуют монослойные пленки на поверхности эпителия.
 а а |
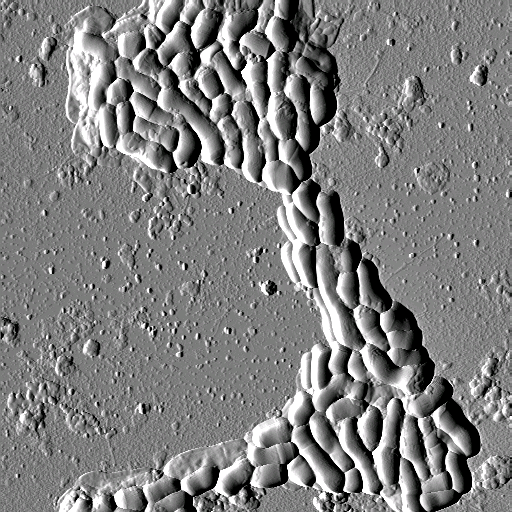 б б |
 в в |
Рис. 6. Изображения монослойных
островковых структур, образованных различными бактериями: Escherihia coli
(а), Klebsiella pneumoniae (б), Helicobacter pylori (в) .
Размеры кадров: 31´ 28 мм2 (а),
40´ 43 мкм2 (б) и 14´
14 мкм2 (в). Бактерии нанесены на поверхность свежесколотой слюды
Наблюдение бактериальных клеток осуществлялось также на других подложках (покровное стекло, полированный титан, пленки из сплава золота и палладия). При адгезии бактерий на поверхности этих субстратов также происходило образование только монослойных островковых структур. При нанесении образцов на поверхность этих подложек высокого смачивания и, соответственно, растекания препарата не наблюдалось. В результате осаждение остаточных примесей из воды происходило в меньшей области подложки, что приводило к декорированию адсорбированными из раствора примесями мелких структурных деталей. Наблюдаемые изображения не давали высокой четкости и контраста. Для высококонтрастного наблюдения бактерий на таких субстратах необходимо предпринимать специальные меры по предварительной отмывке образцов в дистиллированной воде.
Проведенные измерения убедительно демонстрируют возможности метода атомно-силовой микроскопии применительно к визуализации бактериальных клеток с нанометровым пространственным разрешением. Зондовая микроскопия может быть применена для изучения структуры и локальных механических свойств различных прокариотических клеток. С помощью атомно-силового микроскопа становится реальным изучение адгезии клеток к различным субстратам, что может быть чрезвычайно полезным при разработке детергентов для стерилизации хирургического инструмента, при создании новых материалов для пластиковой и полимерной посуды и различных медицинских изделий, при создании контактных глазных линз с антибактерицидными свойствами.
Клеточная стенка прокариот играет роль защитного барьера, предохраняющего бактерию от механического воздействия. В ее состав входят специфические полимерные комплексы, состоящие из липидов, белков и углеводов. Химический состав и строение клеточной стенки постоянны для определенного вида и являются важным свойством, который может служить диагностическим признаком для зондовой микроскопии.
Генетически связанные штаммы бактерий
Внешняя оболочка клеточной стенки грамотрицательных бактерий состоит по большей части из липополисахаридов. Липополисахариды являются углеводсодержащими биополимерами, состоящими из липида А, олигосахаридного остова и О(S)-специфических полисахаридных цепей. Структура этой цепи построена из повторяющихся олигосахаридных блоков и определяет специфичность иммунного ответа высшего организма на инфекцию данным штаммом микроорганизма. Наибольший интерес представляет разработка методов визуализации специфических структур белковой и липополисахаридной природы, важных для физиологических функций бактериальной клетки.
В настоящее время с помощью методов генетического обмена возможно конструирование заданных по характеристике пар штаммов различных видов бактерий, различающихся по структуре биополимеров, которые входят в состав клеточных стенок. Антигены, представленные на поверхности клеток этими биополимерами, детально изучены у ряда патогенных бактерий. Для нас интерес представили штаммы E. coli К12, которые наследуют генетические детерминанты Shigella flexneri, контролирующие синтез основной антигенной структуры из первичных S-специфических боковых цепей липополисахарида О-антигена (антиген 3,4). Так как ранее в генетических экспериментах с шигеллами использовали хорошо изученные многочисленные мутанты штамма E. coli K12 J62, являющегося шероховатым, то в качестве исходного реципиента нами и был применен исходный клон, зависимый по гистидину и удобный для передачи rfb-генов Shigella flexneri, которые сцеплены с his-маркером их хромосомы. Целью настоящей работы явилось выяснение возможности использования атомно-силовой микроскопии для дифференциации поверхности бактериальных клеток Е. coli K12, различающихся по наличию первичных S-специфических боковых цепей липополисахарида О-антигена, контролируемых наследуемым кишечными палочками rfb-геном S. flexneri.
В опытах использовали изогенную пару штаммов: исходный реципиентный штамм E. coli K12 J62 his- trр- pro- и его гибрид E. coli K12 J62 his+ a 3,4+, полученный путем трансдукции фагом Р1 his+ маркера от донорного штамма S.flexneri 2а 516 (II:3,4). Трансдуктант, обозначенный как E.coli K12 J62 his+ a 3,4+ №16-95, агглютинирует с адсорбированной монорецепторной сывороткой 3,4 S. flexneri на стекле в течение 30 с (сразу под петлей). Бактерии трансдуктанта, в отличие от исходной родительской культуры E. coli K12 J62 (Ra-хемотипа), утратили способность лизироваться шероховатым фагом F8 и приобрели лизабельность S-фагом F1.
Бактерии генетически связанной пары штаммов E. coli K12 J62 и E. coli K12 J62 №16-95 выращивали в мясо-пептонном бульоне или мясо-пептонном агаре в течение 16 ч при 37оС. Бактерии в объеме 0,1 мл бульонной культуры разводили в 0,9 мл дистиллированной воды, или готовили смыв с агара в концентрации 1х109 микробных клеток в 1 мл дистиллированной воды. Далее каплю раствора объемом 4 мкл наносили на поверхность свежесколотой слюды. Промежуток времени от приготовления раствора до нанесения его на поверхность подложки варьировали в пределах 1–15 мин. Для этого интервала результаты последующих измерений с помощью АСМ были идентичны. Измерения проводились после естественного высыхания капли раствора, происходившего в течение 15–30 мин. Осуществлялись также контрольные измерения образцов через 15 и 60 дней после их приготовления.
В экспериментальных исследованиях структуры поверхности бактерий применялся атомно-силовой микроскоп Наноскоп-2 фирмы Digital Instruments (Санта-Барбара, США). В качестве зонда был использован кантилевер с острием из нитрида кремния, механическая жесткость кантилеверов составляла 0,06 и 0,12 Н/м. Величина силы взаимодействия между острием и исследуемой поверхностью составляла » 10-9 Н.
Изображения, полученные с помощью атомно-силового микроскопа, показывают, что осаждение бактерий на поверхность слюды при высыхании раствора происходило, как правило, в виде плотноупакованных монослойных островковых образований. Многослойные структуры на изображениях замечены не были. Типичная островковая структура, образованная отдельными бактериями, представлена на рис. 6. Размеры отдельных бактерий варьируются в пределах 1,5–2,5 мкм по длине и 0,4–0,5 мкм по видимой ширине. Высота бактерии составляет 0,05–0,2 мкм и указывает на некоторую деформацию бактерии при адгезии на поверхности слюды. На изображениях одиночных бактерий хорошо различимы длинные отростки — флагеллы длиной 1–6 мкм. Оболочка бактерии имеет хорошо различимую на изображении структурированную поверхность. На основании полученных изображений можно утверждать, что при помещении бактерий в процессе приготовления для исследования в дистиллированную воду лизис клеток не происходил. Применение дистиллированной воды позволило исключить образование солевых отложений, присутствующих в большом количестве при осаждении бактерий из солевого буфера. На АСМ-изображениях иногда заметно незначительное количество вещества, расположенного на поверхности слюды вблизи бактерий и являющегося, по всей видимости, результатом метаболизма бактерий.
Методом атомно-силовой микроскопии [Яминский, Бондаренко, Демин, 1997] проведены исследования клеточной поверхности исходного родительского штамма E. coli K12 J62 his- Ra-хемотипа и трансдуктанта E. coli K12 J62 his+, приобретшего способность синтезировать первичные S-специфические боковые цепи липополисахарида О-антигена Shigella flexneri (группоспецифический фактор 3,4). Сравнительный анализ изображений генетически связанной пары штаммов E. coli K12 J62 выявил существенные различия в топографии поверхностных структур сравниваемых бактериальных клеток, отличающихся по способности синтезировать S-специфические боковые цепи (фактор 3,4) Shigella flexneri, которые представлены повторяющимися молекулами L-рамнозы и N-ацетил-D-глюкозамина.
На рис. 7 представлены изображения исходного штамма E. coli K12 J62 и модифицированного штамма E. coli K12 J62 №16-95, приготовленных описанным выше образом. Заметно общее сходство изображений с предыдущими наблюдениями исходного, немодифицированного, генетически связанного штамма. Атомно-силовая микроскопия выявляет существенные различия в морфологии поверхности сравниваемых штаммов E. coli J62.
 а а |
 б б |
Рис. 7. Изображения исходного родительского
(а) и трансдуктантного (б) штамма E. coli
Размер кадра 4´ 4 мкм2
Для штамма бактерий E. coli K12 J62 №16-95 характерна высокая структурированность поверхности с образованием ламелей в форме продолговатых пластинок. Отдельные ламели имеют длину в диапазоне 200–500 нм при ширине 30–40 нм. Ламели на поверхности штамма плотно упакованы и образуют единую поверхность бактериальной клетки. Для исходного штамма E. coli K12 J62 изображения, полученные с помощью атомно-силового микроскопа, указывают на практически полное отсутствие ламелярной поверхности клеточной стенки. При этом наблюдаются поверхностные структуры, видимая граница раздела между которыми имеет округлую форму. Характерный диаметр этих структур колеблется в пределах 30–50 нм.
Общепризнана роль липополисахарида О-антигена в вирулентности грамотрицательных бактерий. Кластеры генов rfa-rfb обеспечивают биосинтез липополисахарида О-антигена Shigella flexneri, который, как полагают, защищает бактерии от разрушающего действия кислого рН желудочного сока, желчных кислот в просвете желудочно-кишечного тракта, а также местных антител и фагоцитов.
В серии исследований иммунохимической структуры липополисахарида О-антигена S. flexneri, начатых Д. Симмонсом [Simmons, 1971], показано, что в основе липополисахарида сероваров S.flexneri 1-5 лежит структура группового антигена 3,4. Этот антиген включает полисахаридные цепи, содержащие L-рамнозу и N-ацетил-D-глюкозамин. Исключение составляет серовар 6 S. flexneri (S. newcastle). Основная структура антигена V1 включает N-ацетил-галактозамин. Эти данные подтверждены в генетических экспериментах, в которых доказана возможность перехода S.flexneri сероваров 1-5 в исходный “y” вариант в результате замещения при коньюгации с E. coli K12 Hfr-штаммами lac-pro-области хромосомы.
Типовые антигены S. flexneri 1-5 являются модификацией основной структуры (антигена 3,4) и у S. flexneri 2a, и представлены цепями a -глюкозы.
На основании полученных методом атомно-силовой микроскопии изображений мы предполагаем, что наблюдаемые различия в клеточной поверхности гибридных бактерий E. coli K12 обусловлены изменениями морфологии мутантного штамма, наследующего rfb-а3,4 ген Shigella flexneri.
ЛИТЕРАТУРА
Яминский И.В., Демин В.В., Бондаренко В.М. (1997) Различия в клеточной поверхности гибридных бактерий Escherichia coli K12, наследующих rfb-а3,4 ген Shigella flexneri, выявляемые с помощью атомно-силовой микроскопии// Журнал микробиологии, эпидемиологии и иммунобиологии. (6) 15–18.
Яминский И.В., Пышкина О.А., Сергеев В.Г., Семенов А.Э., Филонов А.С. (1997) Визуализация прокариотических клеток с помощью атомно-силовой микроскопии// Зондовая микроскопия-97: Всероссийское совещание по зондовой микроскопии. Н. Новгород: Институт физики микроструктур РАН. 124–127.
Яминский И.В., Бондаренко В.В. (1998) Сканирующая зондовая микроскопия энтеробактерий// В печати.
Oberleithner H., Giebisch G., Geibel J. (1993) European Journal of Phisiology. 425 506–510
Simmons D.A.R. (1971) Immunochemistry of Shigella flexneri O-Antigenes: A Study of Structural and Genetic Aspects of the Biosynthesis of Cell-Surface Antigens//Bacteriological Reviews. 35(2) 117–148.