В основе создания многих биосенсоров лежит закрепление биологически активных молекул, например ферментов или антител, на твердых субстратах. Одним из широко применяемых для этого методов является приготовление мономолекулярных плёнок по технологии Ленгмюра-Блоджет. Метод позволяет упорядочевать и ориентировать молекулы в монослоях заданным образом, обеспечивая максимальную эффективность работы биосенсора.
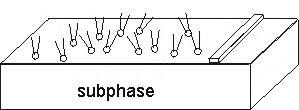
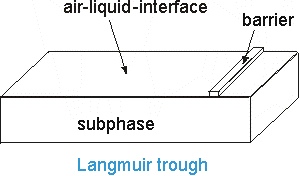
Приготовление ленгмюровских пленок начинается с формирования монослоев поверхностно активных веществ (ПАВ) на межфазной границе жидкость/воздух.
Для этого используют ленгмюровские ванны, которые заполняют водой и раствором солей (субфазой). Они снабжены весами Вильгельми, с помощью которых измеряют поверхностное давление.
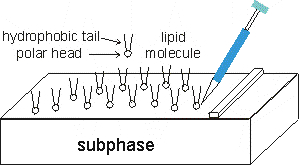
На поверхность субфазы наносят ПАВ, например липиды, жирные кислоты, белки, амфифильные полимеры и др. На межфазной границе молекулы ориентируются так, что их полярные части (например, головки липидов) оказываются погружены в жидкость, а гидрофобные фрагменты (например, углеводородные хвосты) обращены к воздуху.
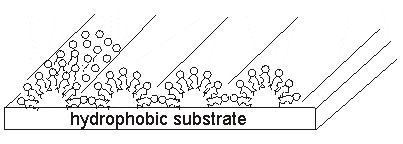
Барьер служит для регулирования поверхностного давления путём изменения площади, покрытой ПАВ. При низком давлении молекулы находятся в состоянии "двумерный газ". Увеличение давления за счёт смещения барьера приводит к образованию упорядоченных монослоёв (твердому состоянию).
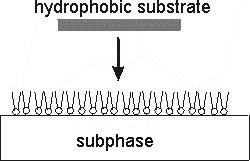
Перенос сформированного монослоя на твердую подложку можно осуществлять различными способами. При иммобилизации белков (ферментов и антител) на гидрофообных подложках часто применяют метод Шеффера.
При контакте гидрофобной подложки с монослоем молекулы прилипают к поверхности. Затем подложку осторожно отрывают, а монослой удерживается там за счет гидрофобного взаимодействия.
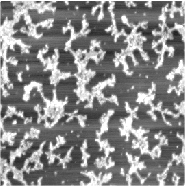
Плёнки Ленгмюра-Блоджет (ЛБ плёнки) хорошо видны в атомно-силовой микроскоп, в некоторых случаях удается получать молекулярное разрешение.
В ленгмюровских плёнках фосфолипидов, перенесенных на поверхность графита по методу Шеффера, образуется жидкокристаллическая фаза, в англоязычной литературе называемая "ripple phase".
В атомно-силовой микроскоп наблюдаются участки плёнки, на которых видны параллельные полоски, соответствующие цилиндрическим мицеллам (ламелям) жидкокристаллической фазы.
Характерно, что углы между направлениями ориентации полосок кратны 60 градусам, что соответствует углам кристаллической решетки графита. По-видимому, образование подобной структуры происходит в процессе взаимодействия молекул фосфолипидов с подложкой при переносе.

Для диагностики различных заболеваний биосенсоры на бактерии и вирусы создают на основе антител. Для этого тебуется ориентировать антитела в монослоях так, чтобы они могли свя зывать антиген, т.е. не теряли своей функциональной активности.
Возникают вопросы:
-
Как иммобилизовать антитела?
-
Какие подложки выбрать?
Перенос антител на графит по методу Шеффера дает плотное покрытие, но, к сожалению, приводит к потере функциональной активности. Кроме того, такие плёнки не очень прочны и часто повреждаются острием зонда в процессе наблюдения. Однако это дает возможность измерить их тощину и убедиться в монослойности покрытия.

Размер кадра
1.5G1.5
m2
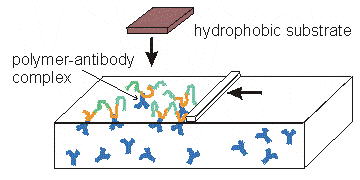
Один из подходов к решению этой проблемы заключается в использовании липидов или амфифильных полиэлектролитов в качестве матрицы для иммобилизации антител. Согласно иммуно-химическим данным это помогает предотвратить инактивацию антител на межфазной границе.
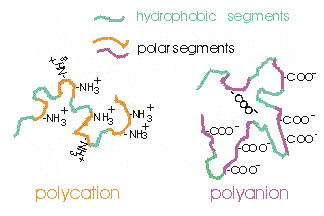
Амфифильные полиэлектролиты содержат как гидрофобные, так и полярные сегменты. В зависимости от знака полярности, различают поликатионы и полианионы.
1. Ленгмюровскую ванну заполняют раствором антител (в нашем случае антител на вирус гепатита B, или HBs антигеном).
2. На поверхность наносят раствор амфифильных полиэлектролитов.
3. Поднимают поверхностное давление до желаемой величины и, дождавшись образования комплексов, переносят плёнку на гидрофобную подложку.
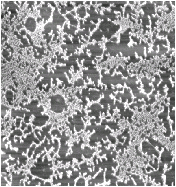
При взгляде в атомно-силовой микроском плёнки представляют собой узорчатые объемные структуры нерегулярного характера. Вид плёнок зависит от того, какой полиэлектролит выбран, а также от поверхностного давления при нанесении.
размер
кадров 2.6G2.6m2
|
20 мН/м |
30 мН/м |
40 мН/м |
размер
кадров 2.6G2.6m2
|
20 мН/м |
30 мН/м |
40 мН/м |
Плёнки антител на основе линейного и разветвленного полиэтилениминов покрывают не всю поверхность, а только ее часть. Программа обработки изображений позволяет вычислить долю покрытия.
|
поверхностное
давление при нанесении, мН/м
|
|||
|
20
|
30
|
40
|
|
|
полиэтиленимин разветвленный |
65%
|
50%
|
45%
|
|
полиэтиленимин линейный |
38%
|
40%
|
56%
|
На практике оказывается, что активность антител в приготовленных таким образом плёнках, т.е. способность плёнок работать как биосенсор, практически одинакова и не зависит от того, какая часть площади подложки покрыта антителами. Объяснение этому факту даёт учёт того, что такая плёнка оказывается трехмерным объектом, и антитела располагаются не на плоской поверхности. Вычисления площади поверхности плёнки, как трёхмерного объекта с помощью программы обработки изображений показывают, что эта величина оказывается примерно одинаковой в указанных случаях. В таблице приводится площадь поверхности пленки в рассчёте на единицу площади сенсора (подложки).
Сополимер метакриловой кислоты и лаурилметакрилата (МАК-ЛМА)

20 мН/м

40 мН/м
На рисунках видно, что плёнка состоит из двух слоёв: гранулярного слоя, содержащего антитела, и расположенных сверху кластеров чистого полимера. Кластеры полимера ухудшают работу плёнки как сенсора, экранируя антитела и препятствуя связыванию антигена. С ростом поверхностного давления при нанесении кластеры сливаются, причём покрываемая ими площадь уменьшается. За этим можно проследить, измеряя площадь "рабочей" части плёнки по изображениям (73% при 20 мН/м и 93% при 40 мН/м).