ПОВЕРХНОСТНЫЕ СИЛЫ
Поверхностные силы
– это силы, действующие на элементы поверхности на границе раздела. Такой
границей может быть, например, поверхность твёрдого тела. Поверхностные силы
возникают между любыми телами вне зависимости от материала и окружающей среды при
сближении тел на расстояние порядка десятков нанометров. Изучением
поверхностных сил занимались уже давно (Юнг, Лаплас, затем Гиббс).
Систематически поверхностные силы изучались Б.В. Дерягиным (с 1935 года).
С появлением
атомно-силовой микроскопии стало возможным непосредственное измерение
поверхностных сил на молекулярных масштабах. Силовое взаимодействие зонда,
сканирующего поверхность образца, и этой поверхности определяется силами
взаимодействия атомов зонда и образца. При этом наибольший вклад во
взаимодействие вносят атомы, находящиеся на поверхности. Для расчёта
взаимодействия зонда с образцом нужно просуммировать вклады от взаимодействия
всех этих атомов. Поэтому необходимо знать природу межмолекулярных сил,
действующих между зондом и образцом.
ПОТЕНЦИАЛЫ МЕЖМОЛЕКУЛЯРНОГО ВЗАИМОДЕЙСТВИЯ
Для расчёта сил,
действующих между молекулами, применяются различные модели потенциалов
межмолекулярного взаимодействия V(r), r – расстояние между молекулами. Распространённой моделью
является потенциал Леннарда-Джонса (1924), описываемый формулой
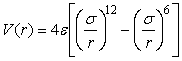 ,
,
где e и s - константы. Первое слагаемое в этой
формуле является эмпирическим и описывает силу отталкивания, действующую между
молекулами на малых расстояниях и обусловленную обменным взаимодействием. Второе
слагаемое отвечает силе притяжения и может быть получено из рассмотрения
электростатического взаимодействия дипольных молекул (см. ниже). Вид потенциала
Леннарда-Джонса схематически изображён на рис.1.
|
|
|
|
|
Рис. 1 Потенциал
Леннарда-Джонса |
Рис. 2 Потенциал
"ступенька" |
Рис. 3 Потенциал
стенки с притяжением |
На рис.2 приведён вид простейшего потенциала взаимодействия –
бесконечной ступеньки. Молекулы не взаимодействуют на расстояниях, больших
определённого значения, и не могут сближаться на малые расстояния. Если бы
молекулы взаимодействовали подобным образом, то атомно-силовой микроскоп был бы
идеальным и давал возможность определить "точный" атомный профиль
поверхности. На рис.3 изображён вид
модельного потенциала для абсолютно твёрдой стенки с притяжением на небольшом
расстоянии и без взаимодействия на большом расстоянии. Этот потенциал, в
отличие от предыдущего, учитывает притяжение между молекулами и иногда
используется в теоретических расчётах. Также в задачах химии и физики поверхности
используется потенциал Букингема (1928), задаваемый формулой
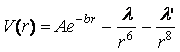 .
.
ОРИЕНТАЦИОННЫЕ, ИНДУКЦИОННЫЕ И ДИСПЕРСИОННЫЕ ВЗАИМОДЕЙСТВИЯ
Рассматривая
электростатическое взаимодействие различных типов молекул (заряженных молекул,
постоянных и индуцированных диполей), можно получить простые формулы для
потенциалов межмолекулярного взаимодействия.
1. Наиболее простой случай -
взаимодействие двух точечных заряженных частиц, описываемое законом Кулона
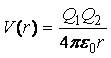 ,
,
где Q1 , Q2 – заряды молекул, e0 = 8.85×10-12 Ф/м –
электрическая постоянная. Однако обычно молекулы оказываются незаряженными,
поэтому приходится рассматривать другие типы взаимодействия.
2. Если одна частица
заряжена (её заряд Q), а другая представляет собой
постоянный диполь величины d, ориентированный под углом q
к линии, соединяющей частицы, то
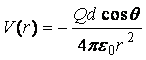 .
.
Однако случай, когда дипольный момент
имеет постоянную ориентацию, встречается редко.
3. В случае заряженной частицы и
свободно вращающегося диполя
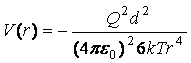 ,
,
где T – температура, k – постоянная Больцмана . Эта формула
может быть получена усреднением предыдущей по углу q в
соответствии с распределением Больцмана. Энергия взаимодействия отрицательна,
значит, заряд и диполь притягиваются.
4. Взаимодействие двух постоянных
диполей d1 и d2 фиксированной ориентации описывается формулой
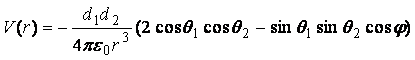 ,
,
где q1 и q2 имеют тот же смысл, что и q
выше, а j -
угол между плоскостями, каждая из которых проходит через один из диполей и
линию, соединяющую диполи. Диполи постоянной величины возникают в примесных
полупроводниках, сегнето- и пьезоэлектриках.
5. Если оба диполя
свободно вращаются, то усреднением предыдущей формулы по углам с учётом
распределения Больцмана можно получить
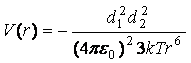 .
.
Взаимодействия постоянных диполей
называются ориентационными. Этот
случай наиболее близок к действительности и наблюдается при взаимодействии,
например, молекул CO2
между собой. Однако многие молекулы неполярны и не обладают постоянным
дипольным моментом (O2,
N2), поэтому необходимо рассматривать
молекулы с наведённым дипольным моментом.
6. Взаимодействие
точечного заряда Q и молекулы, не имеющей заряда,
дипольного, квадрупольного и т.д. моментов, но способной поляризоваться во
внешнем поле и приобретать наведённый дипольный момент, описывается формулой
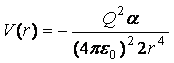 ,
,
где a - поляризуемость молекулы.
7. Если такая молекула взаимодействует
с постоянным диполем d фиксированной ориентации, то
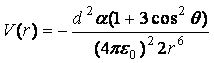 .
.
8. Если такая молекула взаимодействует
со свободно вращающимся диполем, то усреднением по углам можно получить
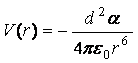 .
.
Эта формула описывает индукционные взаимодействия, то есть
взаимодействия с участием наведённых диполей, она выражает так называемую
энергию Дебая индукционного взаимодействия.
9. Взаимодействие
возможно и между двумя электрически нейтральными молекулами, не имеющими
постоянных дипольных и т.д. моментов. В данном случае взаимодействуют
мгновенные дипольные моменты, имеющиеся у каждой из молекул. Средний по времени
дипольный момент равен нулю, однако средняя сила оказывается отличной от нуля.
В этом случае, предполагая известным распределение электронной плотности каждой
из молекул и используя закон Кулона, можно получить формулу
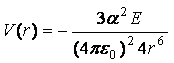 ,
,
где E – первый потенциал ионизации молекулы.
Если молекулы различные, то E нужно
заменить на квадратный корень из произведения потенциалов ионизации молекул: E ® ![]() . Данная
формула описывает дисперсионные
взаимодействия, то есть взаимодействия мгновенных диполей, а потенциал носит
название потенциала Лондона. Дисперсионные взаимодействия универсальны, они
возникают между любыми атомами и молекулами.
. Данная
формула описывает дисперсионные
взаимодействия, то есть взаимодействия мгновенных диполей, а потенциал носит
название потенциала Лондона. Дисперсионные взаимодействия универсальны, они
возникают между любыми атомами и молекулами.
Таким образом, расчёт
взаимодействия атомов и молекул может быть сведён к рассмотрению простых
случаев взаимодействия зарядов и диполей. Силы, действующие между молекулами
зонда и образца в атомно-силовом микроскопе, могут быть рассчитаны с
привлечением моделей потенциалов межмолекулярного взаимодействия. Поверхностные
силы, обусловленные взаимодействием атомов и молекул, могут быть измерены
экспериментально при помощи атомно-силовой микроскопии.
Литература
(1)
Дерягин
Б.В., Чураев Н.В., Муллер М.В. Поверхностные силы. М.: Наука, 1985
(2)
Israelachvili J.N. Intermolecular and surface forces: with application to colloidal and biological systems, 2nd
Ed. Academic Press, 1992
(3)
Адамсон А. Физическая химия поверхностей. М.: Мир,
1979
(4)
Гиршфельдер Дж., Кертисс Ч., Берд Р. Молекулярная теория газов и
жидкостей. М.: Изд-во ин. лит., 1961
(5)
Бэкингем Э. Межмолекулярные взаимодействия: от
двухатомных молекул до биополимеров. М.: Мир, 1981
(6)
Каплан И.Г. Введение
в теорию межмолекулярных взаимодействий. М.: Наука, 1982
(7)
Molecular
Interactions. Ratajczak
H., Orville-Thomas W.J. eds.
(8)
www.ntmdt.ru


